Kozmetički proizvodi
Što su kozmetički proizvodi
Kozmetički proizvod je svaka tvar ili smjesa koja je namijenjena dodiru s vanjskim dijelovima ljudskog tijela (koža, kosa i vlasište, nokti, usnice i vanjski spolni organi) ili sa zubima i sluznicom usne šupljine isključivo ili prvenstveno radi njihova čišćenja, parfimiranja, i/ili zaštite i održavanja u dobrom stanju, mijenjanja njihova izgleda i/ili korekcije tjelesnih mirisa.
Kozmetički proizvodi mogu graničiti i sa sljedećim propisima koji uključuju:
• lijekove
• medicinske proizvode
• tradicionalne biljne lijekove i/ili
• biocidne proizvode.
Proizvodi koji sadrže tvari ili smjese koje su namijenjene gutanju, udisanju, ubrizgavanju ili ugrađivanju u ljudsko tijelo ne smatraju se kozmetičkim proizvodima.
Kako bi se osigurala usklađenost putem jedinstvenog tržišta glede kategorizacije proizvoda, Europska komisija je objavila niz smjernica i vodiča za razgraničavanje proizvoda između kozmetičkih proizvoda i drugih kategorija proizvoda, kako bi se utvrdilo da li proizvod spada pod definiciju iz članka 2. Uredbe 1223/2009 o kozmetičkim proizvodima.
Predstavljanje proizvoda (uključujući sve komunikacijske medije) i određivanje njegove namjene od strane proizvođača, mora osigurati da taj kozmetički proizvod spada u okvir definicije iz članka 2. Uredbe 1223/2009 o kozmetičkim proizvodima.
Kozmetički proizvodi mogu graničiti i sa sljedećim propisima koji uključuju:
• lijekove
• medicinske proizvode
• tradicionalne biljne lijekove i/ili
• biocidne proizvode.
Proizvodi koji sadrže tvari ili smjese koje su namijenjene gutanju, udisanju, ubrizgavanju ili ugrađivanju u ljudsko tijelo ne smatraju se kozmetičkim proizvodima.
Kako bi se osigurala usklađenost putem jedinstvenog tržišta glede kategorizacije proizvoda, Europska komisija je objavila niz smjernica i vodiča za razgraničavanje proizvoda između kozmetičkih proizvoda i drugih kategorija proizvoda, kako bi se utvrdilo da li proizvod spada pod definiciju iz članka 2. Uredbe 1223/2009 o kozmetičkim proizvodima.
Predstavljanje proizvoda (uključujući sve komunikacijske medije) i određivanje njegove namjene od strane proizvođača, mora osigurati da taj kozmetički proizvod spada u okvir definicije iz članka 2. Uredbe 1223/2009 o kozmetičkim proizvodima.
Zakonodavstvo
Uredba (EZ) br. 1223/2009 Europskog parlamenta i Vijeća od 30. studenoga 2009. o kozmetičkim proizvodima
Uredba (EZ) br. 655/2013 оd 10. srpnja 2013. o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji koje se koriste u vezi s kozmetičkim proizvodima
Zakon o provedbi Uredbe (EZ) br. 1223/2009 Europskog parlamenta i Vijeća od 30. studenoga 2009. o kozmetičkim proizvodima
Uredba (EZ) br. 655/2013 оd 10. srpnja 2013. o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji koje se koriste u vezi s kozmetičkim proizvodima
Zakon o provedbi Uredbe (EZ) br. 1223/2009 Europskog parlamenta i Vijeća od 30. studenoga 2009. o kozmetičkim proizvodima
Reklamiranje kozmetičkih proizvoda i uporaba tvrdnji
Prilikom označivanja, osiguranja dostupnosti na tržištu i reklamiranja kozmetičkih proizvoda nije dopušteno koristiti tekst, imena, robne žigove, slike i simbolične ili druge oznake kojima se tim proizvodima pripisuju obilježja ili funkcije koje oni nemaju.
Zabranjeno je reklamirati kozmetičke proizvode na način koji bi potrošače mogao dovesti u zabludu glede njegovog stvarnog sastava, svojstava i namjene. Isto tako, zabranjeno je pripisivanje i reklamiranje ljekovitog svojstva.
Na razini Europske unije postoji popis zajedničkih kriterija za opravdanje tvrdnji koje se koriste na kozmetičkim proizvodima, a čiji je glavni cilj osigurati visoku razinu zaštite krajnjih korisnika, posebno lažnih tvrdnji koje se nalaze na kozmetičkim proizvodima.
Zajednički kriteriji za opravdanje tvrdnji objavljeni su u Službenom listu EU kao Uredba Komisije (EU) br. 655/2013 оd 10. srpnja 2013. o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji koje se koriste u vezi s kozmetičkim proizvodima. Isto tako, objavljene su i Smjernice Komisije za primjenu Uredbe br. 655/2013.
Tvrdnje na kozmetičkim proizvodima služe za informiranje krajnjih korisnika o obilježjima i kvaliteti proizvoda. One su ključne za razlikovanje proizvoda te pridonose i potiču inovativnost i konkurentnost. Važno je osigurati da su informacije priopćene tim tvrdnjama korisne, razumljive i pouzdane i da omogućuju pravilan odabir kozmetičkog proizvoda koji najbolje odgovara potrebi i očekivanjima korisnika.
Kako bi se pomoglo proizvođačima i oglašivačima kozmetičkih proizvoda, Europska udruga proizvođača kozmetike (Cosmetics Europe) izradila je Smjernice o odgovornom oglašavanju i marketinškoj komunikaciji kozmetičkih proizvoda. Smjernice su dostupne na engleskom jeziku.
Zabranjeno je reklamirati kozmetičke proizvode na način koji bi potrošače mogao dovesti u zabludu glede njegovog stvarnog sastava, svojstava i namjene. Isto tako, zabranjeno je pripisivanje i reklamiranje ljekovitog svojstva.
Na razini Europske unije postoji popis zajedničkih kriterija za opravdanje tvrdnji koje se koriste na kozmetičkim proizvodima, a čiji je glavni cilj osigurati visoku razinu zaštite krajnjih korisnika, posebno lažnih tvrdnji koje se nalaze na kozmetičkim proizvodima.
Zajednički kriteriji za opravdanje tvrdnji objavljeni su u Službenom listu EU kao Uredba Komisije (EU) br. 655/2013 оd 10. srpnja 2013. o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji koje se koriste u vezi s kozmetičkim proizvodima. Isto tako, objavljene su i Smjernice Komisije za primjenu Uredbe br. 655/2013.
Tvrdnje na kozmetičkim proizvodima služe za informiranje krajnjih korisnika o obilježjima i kvaliteti proizvoda. One su ključne za razlikovanje proizvoda te pridonose i potiču inovativnost i konkurentnost. Važno je osigurati da su informacije priopćene tim tvrdnjama korisne, razumljive i pouzdane i da omogućuju pravilan odabir kozmetičkog proizvoda koji najbolje odgovara potrebi i očekivanjima korisnika.
Kako bi se pomoglo proizvođačima i oglašivačima kozmetičkih proizvoda, Europska udruga proizvođača kozmetike (Cosmetics Europe) izradila je Smjernice o odgovornom oglašavanju i marketinškoj komunikaciji kozmetičkih proizvoda. Smjernice su dostupne na engleskom jeziku.
Sadržaj i način deklariranja kozmetičkih proizvoda
Kozmetički proizvodi stavljaju se na tržište samo ako se na posudi i ambalaži kozmetičkih proizvoda nalaze sljedeći podaci ispisani neizbrisivim, jasno čitljivim i vidljivim slovima:
(a) ime ili registrirano ime i adresa odgovorne osobe.
Te je podatke moguće skratiti ako to skraćenje omogućava identifikaciju te osobe i njezine adrese. Ako je navedeno nekoliko adresa, potrebno je istaknuti onu adresu na kojoj odgovorna osoba ima izravno dostupnu dokumentaciju s podacima o proizvodu.
Za uvezene kozmetičke proizvode potrebno je navesti i državu podrijetla.
(b) nominalni sadržaj u trenutku pakiranja (naveden u obliku mase ili obujma), osim u slučaju ambalaže koja sadrži manje od pet grama ili pet mililitara, besplatnih uzoraka i pakiranja za jednokratnu uporabu; za pretpakovine koje se prodaju kao komplet proizvoda, a za koje podaci o masi ili obujmu nisu bitni, nije potrebno navesti sadržaj pod uvjetom da je na ambalaži naznačen broj proizvoda.
Te podatke nije potrebno navesti ako je broj proizvoda lako vidljiv izvana ili ako se proizvod obično prodaje samo pojedinačno;
(c) datum do kojeg će kozmetički proizvod u odgovarajućim uvjetima skladištenja zadržati svoju prvotnu funkciju te će posebno ostati sukladan članku 3. („najkraći rok trajanja”) Uredbe 1223/2009.
Prije samog datuma ili podataka o tome gdje se on nalazi na ambalaži mora biti naveden simbol iz točke 3. Priloga VII. Uredbe 1223/2009 ili riječi: „najbolje upotrijebiti prije kraja”.
Najkraći rok trajanja mora biti jasno naznačen i sastavljen je od mjeseca i godine ili dana, mjeseca i godine, tim redom. Po potrebi se taj podatak dopunjava uvjetima koje je potrebno ispuniti kako bi se moglo zajamčiti navedeno trajanje.
Navođenje najkraćeg roka trajanja nije obvezno za kozmetičke proizvode s najkraćim rokom trajanja duljim od 30 mjeseci. Za takve je proizvode potrebno navesti razdoblje nakon otvaranja do isteka kojeg je proizvod siguran i potrošač ga može koristiti bez ikakve opasnosti. Ti se podaci označuju, uz iznimku slučajeva u kojima pojam trajanja nakon otvaranja proizvoda nije bitan, simbolom iz točke 2. Priloga VII. Uredbe 1223/2009, iza kojeg slijedi razdoblje trajanja (u mjesecima i/ili godinama);
Simboli:


Europska komisija je izradila Smjernice glede deklariranja trajnosti kozmetičkog proizvoda: period nakon otvaranja proizvoda.
(d) posebne mjere opreza koje je potrebno poštovati prilikom uporabe, te barem one iz priloga III. do VI. Uredbe 1223/2009 i bilo koja upozorenja o kozmetičkim proizvodima za profesionalnu uporabu;
(e) serijski broj proizvodnje ili referentni broj za identifikaciju kozmetičkog proizvoda. Ako to nije moguće iz praktičnih razloga budući da su kozmetički proizvodi premali, ti se podaci moraju navesti na ambalaži;
(f) funkcija kozmetičkog proizvoda, osim ako to nije jasno iz njegova izgleda;
(g) popis sastojaka. Ovaj se podatak može navesti samo na ambalaži. Ispred popisa mora stajati izraz: „sastojci”. Sastojci se navode u INCI nazivlju - Međunarodnom nazivlju sastojaka kozmetičkih proizvoda.
Popis sastojaka navodi se silaznim redoslijedom s obzirom na njihovu masu u vrijeme kada su dodani kozmetičkom proizvodu. Sastojci u koncentracijama manjim od 1 % mogu se navesti bilo kojim redoslijedom nakon sastojaka u koncentracijama većim od 1 %.
Svi sastojci prisutni u obliku nanomaterijala moraju biti jasno naznačeni na popisu sastojaka. Nakon imena tih sastojaka u zagradi mora slijediti riječ „nano”.
Bojila koja nisu namijenjena bojenju kose mogu se navesti bilo kojim redoslijedom nakon ostalih kozmetičkih sastojaka. Za ukrasne kozmetičke proizvode koji se prodaju u više nijansi boja moguće je navesti sva bojila u paleti, osim onih koja su namijenjena bojenju kose, pod uvjetom da se dodaju riječi „može sadržavati” ili simbol „+/-”. Po potrebi je moguće upotrijebiti nazivlje CI (Colour Index).
Europska komisija je putem CosIng baze objavila popis tvari i sastojaka koji se mogu nalaziti u kozmetičkim proizvodima.
(a) ime ili registrirano ime i adresa odgovorne osobe.
Te je podatke moguće skratiti ako to skraćenje omogućava identifikaciju te osobe i njezine adrese. Ako je navedeno nekoliko adresa, potrebno je istaknuti onu adresu na kojoj odgovorna osoba ima izravno dostupnu dokumentaciju s podacima o proizvodu.
Za uvezene kozmetičke proizvode potrebno je navesti i državu podrijetla.
(b) nominalni sadržaj u trenutku pakiranja (naveden u obliku mase ili obujma), osim u slučaju ambalaže koja sadrži manje od pet grama ili pet mililitara, besplatnih uzoraka i pakiranja za jednokratnu uporabu; za pretpakovine koje se prodaju kao komplet proizvoda, a za koje podaci o masi ili obujmu nisu bitni, nije potrebno navesti sadržaj pod uvjetom da je na ambalaži naznačen broj proizvoda.
Te podatke nije potrebno navesti ako je broj proizvoda lako vidljiv izvana ili ako se proizvod obično prodaje samo pojedinačno;
(c) datum do kojeg će kozmetički proizvod u odgovarajućim uvjetima skladištenja zadržati svoju prvotnu funkciju te će posebno ostati sukladan članku 3. („najkraći rok trajanja”) Uredbe 1223/2009.
Prije samog datuma ili podataka o tome gdje se on nalazi na ambalaži mora biti naveden simbol iz točke 3. Priloga VII. Uredbe 1223/2009 ili riječi: „najbolje upotrijebiti prije kraja”.
Najkraći rok trajanja mora biti jasno naznačen i sastavljen je od mjeseca i godine ili dana, mjeseca i godine, tim redom. Po potrebi se taj podatak dopunjava uvjetima koje je potrebno ispuniti kako bi se moglo zajamčiti navedeno trajanje.
Navođenje najkraćeg roka trajanja nije obvezno za kozmetičke proizvode s najkraćim rokom trajanja duljim od 30 mjeseci. Za takve je proizvode potrebno navesti razdoblje nakon otvaranja do isteka kojeg je proizvod siguran i potrošač ga može koristiti bez ikakve opasnosti. Ti se podaci označuju, uz iznimku slučajeva u kojima pojam trajanja nakon otvaranja proizvoda nije bitan, simbolom iz točke 2. Priloga VII. Uredbe 1223/2009, iza kojeg slijedi razdoblje trajanja (u mjesecima i/ili godinama);
Simboli:
Rok trajanja nakon Najkraći rok trajanja: Uputa na priložene
otvaranja: informacije:
otvaranja: informacije:



Europska komisija je izradila Smjernice glede deklariranja trajnosti kozmetičkog proizvoda: period nakon otvaranja proizvoda.
(d) posebne mjere opreza koje je potrebno poštovati prilikom uporabe, te barem one iz priloga III. do VI. Uredbe 1223/2009 i bilo koja upozorenja o kozmetičkim proizvodima za profesionalnu uporabu;
(e) serijski broj proizvodnje ili referentni broj za identifikaciju kozmetičkog proizvoda. Ako to nije moguće iz praktičnih razloga budući da su kozmetički proizvodi premali, ti se podaci moraju navesti na ambalaži;
(f) funkcija kozmetičkog proizvoda, osim ako to nije jasno iz njegova izgleda;
(g) popis sastojaka. Ovaj se podatak može navesti samo na ambalaži. Ispred popisa mora stajati izraz: „sastojci”. Sastojci se navode u INCI nazivlju - Međunarodnom nazivlju sastojaka kozmetičkih proizvoda.
Popis sastojaka navodi se silaznim redoslijedom s obzirom na njihovu masu u vrijeme kada su dodani kozmetičkom proizvodu. Sastojci u koncentracijama manjim od 1 % mogu se navesti bilo kojim redoslijedom nakon sastojaka u koncentracijama većim od 1 %.
Svi sastojci prisutni u obliku nanomaterijala moraju biti jasno naznačeni na popisu sastojaka. Nakon imena tih sastojaka u zagradi mora slijediti riječ „nano”.
Bojila koja nisu namijenjena bojenju kose mogu se navesti bilo kojim redoslijedom nakon ostalih kozmetičkih sastojaka. Za ukrasne kozmetičke proizvode koji se prodaju u više nijansi boja moguće je navesti sva bojila u paleti, osim onih koja su namijenjena bojenju kose, pod uvjetom da se dodaju riječi „može sadržavati” ili simbol „+/-”. Po potrebi je moguće upotrijebiti nazivlje CI (Colour Index).
Europska komisija je putem CosIng baze objavila popis tvari i sastojaka koji se mogu nalaziti u kozmetičkim proizvodima.
Odgovorna osoba za kozmetičke proizvode
Na tržište se smiju stavljati samo oni kozmetički proizvodi za koje je pravna ili fizička osoba u Europskoj uniji imenovana „odgovornom osobom”.
Odgovorna osoba je proizvođač odnosno bilo koja fizička ili pravna osoba koja proizvodi kozmetički proizvod ili za koju se takav proizvod dizajnira ili proizvodi, te koja stavlja taj kozmetički proizvod na tržište pod svojim imenom ili žigom.
Odgovorna osoba je i uvoznik odnosno bilo koja fizička ili pravna osoba s poslovnim nastanom u Zajednici, koja stavlja kozmetički proizvod iz treće zemlje na tržište Unije.
Proizvođač može pismeno imenovati osobu s poslovnim nastanom u Zajednici kao odgovornu osobu, koja to mora pismeno prihvatiti.
Uvoznik može pismeno imenovati osobu s poslovnim nastanom u Zajednici kao odgovornu osobu, koja to mora pismeno prihvatiti.
Obveze proizvođača ili uvoznika:
• izraditi procjenu sigurnosti i izvješće o sigurnosti kozmetičkog proizvoda;
• voditi dokumentaciju s podacima o proizvodu (10 godina);
• izvršiti elektroničkim putem notifikaciju kozmetičkih proizvoda Europskoj komisiji (CPNP prijava);
• izvršiti elektroničkim putem notifikaciju kozmetičkih proizvoda ukoliko sadrže tvari u obliku nanomaterijala Europskoj komisiji (CPNP prijava);
• deklarirati kozmetički proizvod u skladu sa zakonskim propisima;
• prikupljati podatke o ozbiljnim neželjenim učincima kozmetičkog proizvoda (koji su posljedica uporabe kozmetičkog proizvoda).
Distributer je odgovorna osoba ako stavlja kozmetički proizvod na tržište pod svojim imenom ili robnim žigom, ili ako izmijeni proizvod već stavljen na tržište tako da to može utjecati na njegovu sukladnost s primjenjivim zahtjevima.
Prijevod podataka o kozmetičkom proizvodu koji je već stavljen na tržište ne smatra se izmjenom tog proizvoda koja može utjecati na njegovu sukladnost s primjenjivim zahtjevima Uredbe.
Distributer mora osigurati sljedeće:
• da je kozmetički proizvod označen podacima iz članka 19. Uredbe 1223/2009;
• da su ispunjeni svi zahtjevi u pogledu jezika;
• da nije istekao najkraći rok trajanja;
• da uvjeti skladištenja ili prijevoza ne ugroze usklađenost sa zahtjevima Uredbe 1223/2009;
• ukoliko kozmetički proizvod predstavlja rizik za zdravlje ljudi, o tome odmah obavijestiti odgovornu osobu i nadležno tijelo.
Odgovorna osoba je proizvođač odnosno bilo koja fizička ili pravna osoba koja proizvodi kozmetički proizvod ili za koju se takav proizvod dizajnira ili proizvodi, te koja stavlja taj kozmetički proizvod na tržište pod svojim imenom ili žigom.
Odgovorna osoba je i uvoznik odnosno bilo koja fizička ili pravna osoba s poslovnim nastanom u Zajednici, koja stavlja kozmetički proizvod iz treće zemlje na tržište Unije.
Proizvođač može pismeno imenovati osobu s poslovnim nastanom u Zajednici kao odgovornu osobu, koja to mora pismeno prihvatiti.
Uvoznik može pismeno imenovati osobu s poslovnim nastanom u Zajednici kao odgovornu osobu, koja to mora pismeno prihvatiti.
Obveze proizvođača ili uvoznika:
• izraditi procjenu sigurnosti i izvješće o sigurnosti kozmetičkog proizvoda;
• voditi dokumentaciju s podacima o proizvodu (10 godina);
• izvršiti elektroničkim putem notifikaciju kozmetičkih proizvoda Europskoj komisiji (CPNP prijava);
• izvršiti elektroničkim putem notifikaciju kozmetičkih proizvoda ukoliko sadrže tvari u obliku nanomaterijala Europskoj komisiji (CPNP prijava);
• deklarirati kozmetički proizvod u skladu sa zakonskim propisima;
• prikupljati podatke o ozbiljnim neželjenim učincima kozmetičkog proizvoda (koji su posljedica uporabe kozmetičkog proizvoda).
Distributer je odgovorna osoba ako stavlja kozmetički proizvod na tržište pod svojim imenom ili robnim žigom, ili ako izmijeni proizvod već stavljen na tržište tako da to može utjecati na njegovu sukladnost s primjenjivim zahtjevima.
Prijevod podataka o kozmetičkom proizvodu koji je već stavljen na tržište ne smatra se izmjenom tog proizvoda koja može utjecati na njegovu sukladnost s primjenjivim zahtjevima Uredbe.
Distributer mora osigurati sljedeće:
• da je kozmetički proizvod označen podacima iz članka 19. Uredbe 1223/2009;
• da su ispunjeni svi zahtjevi u pogledu jezika;
• da nije istekao najkraći rok trajanja;
• da uvjeti skladištenja ili prijevoza ne ugroze usklađenost sa zahtjevima Uredbe 1223/2009;
• ukoliko kozmetički proizvod predstavlja rizik za zdravlje ljudi, o tome odmah obavijestiti odgovornu osobu i nadležno tijelo.
Dokumentacija s podacima o kozmetičkom proizvodu
Dokumentacija s podacima o kozmetičkom proizvodu mora sadržavati sljedeće informacije i podatke:
1. opis kozmetičkog proizvoda koji omogućuje da se dokumentacija s podacima o proizvodu jasno poveže s kozmetičkim proizvodom,
2. izvješće o sigurnosti kozmetičkog proizvoda,
3. opis proizvodne metode i izjavu o sukladnosti s dobrom proizvodnom praksom
4. ako je to opravdano zbog prirode ili učinka kozmetičkog proizvoda, dokaz o učinku za koji se tvrdi da ga posjeduje kozmetički proizvod,
5. podatke o bilo kakvim ispitivanjima na životinjama koje su izvršili proizvođač, njegovi zastupnici ili dobavljači u vezi s razvojem ili procjenom sigurnosti kozmetičkog proizvoda ili njegovih sastojaka, uključujući bilo koje ispitivanje na životinjama izvršeno kako bi se ispunili zakonski ili regulatorni zahtjevi trećih zemalja.
Dokumentaciju s podacima o proizvodu odgovorna osoba čuva deset godina od datuma kada je posljednja serija kozmetičkog proizvoda stavljena na tržište.
Smjernice za izradu dokumentacije s podacima o proizvodu (P.I.F.)
Procjena sigurnosti kozmetičkog proizvoda (Safety assessment)
Prije stavljanja kozmetičkog proizvoda na tržište odgovorna osoba osigurava da je kozmetički proizvod podvrgnut procjeni sigurnosti te da je izvješće o sigurnosti kozmetičkog proizvoda sastavljeno u skladu s Prilogom I. Uredbe 1223/2009.
Procjenu sigurnosti kozmetičkog proizvoda može izraditi osoba koja posjeduje diplomu ili neki drugi dokaz formalne osposobljenosti dobiven po završetku sveučilišnog teoretskog i praktičnog studija farmacije, toksikologije, medicine ili slične discipline te studija koji se u državi članici priznaje kao jednakovrijedan.
Izvješće o sigurnosti kozmetičkog proizvoda sastoji se od:
Dio A – podaci o sigurnosti kozmetičkog proizvoda (kvantitativni i kvalitativni sastav kozmetičkog proizvoda, fizikalno—kemijska svojstva i stabilnost kozmetičkog proizvoda, mikrobiološka kakvoća, nečistoće, tragovi, podaci o ambalažnom materijalu, uobičajeni i razumno predvidljivi uvjeti uporabe, izloženost kozmetičkom proizvodu, izloženost tvarima, toksikološki profil tvari, neželjeni učinci i ozbiljni neželjeni učinci, podaci o kozmetičkom proizvodu) i
Dio B – Ocjena sigurnosti kozmetičkog proizvoda (zaključak ocjene, navođenje upozorenja i uputa za uporabu, obrazloženje, vjerodostojnost ocjenjivača i odobrenje dijela B).
Detaljni sadržaj Izvješća o sigurnosti kozmetičkog proizvoda nalazi se u Prilogu I. Uredbe 1223/2009 o kozmetičkim proizvodima.
1. opis kozmetičkog proizvoda koji omogućuje da se dokumentacija s podacima o proizvodu jasno poveže s kozmetičkim proizvodom,
2. izvješće o sigurnosti kozmetičkog proizvoda,
3. opis proizvodne metode i izjavu o sukladnosti s dobrom proizvodnom praksom
4. ako je to opravdano zbog prirode ili učinka kozmetičkog proizvoda, dokaz o učinku za koji se tvrdi da ga posjeduje kozmetički proizvod,
5. podatke o bilo kakvim ispitivanjima na životinjama koje su izvršili proizvođač, njegovi zastupnici ili dobavljači u vezi s razvojem ili procjenom sigurnosti kozmetičkog proizvoda ili njegovih sastojaka, uključujući bilo koje ispitivanje na životinjama izvršeno kako bi se ispunili zakonski ili regulatorni zahtjevi trećih zemalja.
Dokumentaciju s podacima o proizvodu odgovorna osoba čuva deset godina od datuma kada je posljednja serija kozmetičkog proizvoda stavljena na tržište.
Smjernice za izradu dokumentacije s podacima o proizvodu (P.I.F.)
Procjena sigurnosti kozmetičkog proizvoda (Safety assessment)
Prije stavljanja kozmetičkog proizvoda na tržište odgovorna osoba osigurava da je kozmetički proizvod podvrgnut procjeni sigurnosti te da je izvješće o sigurnosti kozmetičkog proizvoda sastavljeno u skladu s Prilogom I. Uredbe 1223/2009.
Procjenu sigurnosti kozmetičkog proizvoda može izraditi osoba koja posjeduje diplomu ili neki drugi dokaz formalne osposobljenosti dobiven po završetku sveučilišnog teoretskog i praktičnog studija farmacije, toksikologije, medicine ili slične discipline te studija koji se u državi članici priznaje kao jednakovrijedan.
Izvješće o sigurnosti kozmetičkog proizvoda sastoji se od:
Dio A – podaci o sigurnosti kozmetičkog proizvoda (kvantitativni i kvalitativni sastav kozmetičkog proizvoda, fizikalno—kemijska svojstva i stabilnost kozmetičkog proizvoda, mikrobiološka kakvoća, nečistoće, tragovi, podaci o ambalažnom materijalu, uobičajeni i razumno predvidljivi uvjeti uporabe, izloženost kozmetičkom proizvodu, izloženost tvarima, toksikološki profil tvari, neželjeni učinci i ozbiljni neželjeni učinci, podaci o kozmetičkom proizvodu) i
Dio B – Ocjena sigurnosti kozmetičkog proizvoda (zaključak ocjene, navođenje upozorenja i uputa za uporabu, obrazloženje, vjerodostojnost ocjenjivača i odobrenje dijela B).
Detaljni sadržaj Izvješća o sigurnosti kozmetičkog proizvoda nalazi se u Prilogu I. Uredbe 1223/2009 o kozmetičkim proizvodima.
Europska komisija je donijela i Odluku o Smjernicama za primjenu Priloga I. Uredbe (EZ) br. 1223/2009. Smjernice su osobito korisne za male i srednje proizvođače kako bi ispunili uvjete za izradu izvješća o sigurnosti kozmetičkih proizvoda.
Notifikacija kozmetičkih proizvoda (CPNP prijava)
Prije stavljanja kozmetičkog proizvoda na tržište, odgovorna osoba (proizvođač, uvoznik i u nekim slučajevima distributer) obvezna je prijaviti/notificirati kozmetičke proizvode Europskoj komisiji.
Odgovorna osoba u elektroničkom obliku dostavlja Europskoj komisiji sljedeće podatke:
1. kategoriju kozmetičkog proizvoda i njegovo ime ili imena, što omogućuje njegovu identifikaciju;
2. ime i adresu odgovorne osobe pri kojoj je izravno dostupna dokumentacija s podacima o proizvodu;
3. državu podrijetla u slučaju uvoza;
4. državu članicu u kojoj će se kozmetički proizvod staviti na tržište;
5. kontaktne podatke fizičke osobe s kojom je prema potrebi moguće stupiti u kontakt;
6. prisutnost tvari u obliku nanomaterijala, i:
a) njihovu identifikaciju, uključujući kemijski naziv (IUPAC) i druge deskriptore kako je utvrđeno u točki 2. preambule priloga II. do VI. Uredbe 1223/2009;
b) razumno predvidljive uvjete izloženosti;
7. ime i broj CAS (Chemicals Abstracts Service) ili EZ broj za tvari koje su razvrstane kao karcinogene, mutagene ili toksične za reprodukciju (CMR) kategorije 1A ili 1B u skladu s dijelom 3. Priloga VI. Uredbi (EZ) br. 1272/2008;
8. okvirnu formulaciju koja omogućuje brzo i primjereno liječenje u slučaju poteškoća.
Kada se kozmetički proizvod stavlja na tržište, odgovorna osoba dostavlja Europskoj komisiji podatke o izvornoj oznaci, i ako je čitljiva, fotografiju odnosne ambalaže.
Distributer koji osigurava dostupnost u državi članici kozmetičkog proizvoda koji je već stavljen na tržište druge države članice te na vlastitu inicijativu prevede podatke na oznaci proizvoda kako bi se uskladio s nacionalnim pravom, dostavlja Europskoj komisiji u elektroničkom obliku sljedeće podatke:
1. kategoriju kozmetičkog proizvoda, njegovo ime u državi članici otpreme i njegovo ime u državi članici u kojoj postaje dostupan, što omogućuje njegovu identifikaciju;
2. državu članicu u kojoj kozmetički proizvod postaje dostupan;
3. vlastito ime i adresu;
4. ime i adresu odgovorne osobe pri kojoj je izravno dostupna dokumentacija s podacima o proizvodu.
Notifikacija/obavješćivanje kozmetičkih proizvoda vrši se elektroničkim putem preko portala CPNP (eng. Cosmetic products notification portal) koji je dostupan na mrežnim stranicama Europske komisije.
CPNP portal je dostupan na sljedećoj internetskoj stranici: http://ec.europa.eu/growth/sectors/cosmetics/cpnp/index_en.htm
Na navedenim mrežnim stranicama nalaze se Korisnički priručnici za prijavu kozmetičkog proizvoda na CPNP portal sukladno članku 13. i članku 16. Uredbe 1223/2009, a koji služe kao korisno sredstvo upoznavanja s načinom registracije u sustav, kao i korištenjem portala za notifikaciju kozmetičkih proizvoda.
Dužnost svake odgovorne osobe je da unutar svoje tvrtke/obrta/OPG-a odredi odgovornu osobu koja će se registrirati na portal i notificirati proizvode.
Upute za prijavu na portal CPNP
CPNP - hodogram aktivnosti
Odgovorna osoba u elektroničkom obliku dostavlja Europskoj komisiji sljedeće podatke:
1. kategoriju kozmetičkog proizvoda i njegovo ime ili imena, što omogućuje njegovu identifikaciju;
2. ime i adresu odgovorne osobe pri kojoj je izravno dostupna dokumentacija s podacima o proizvodu;
3. državu podrijetla u slučaju uvoza;
4. državu članicu u kojoj će se kozmetički proizvod staviti na tržište;
5. kontaktne podatke fizičke osobe s kojom je prema potrebi moguće stupiti u kontakt;
6. prisutnost tvari u obliku nanomaterijala, i:
a) njihovu identifikaciju, uključujući kemijski naziv (IUPAC) i druge deskriptore kako je utvrđeno u točki 2. preambule priloga II. do VI. Uredbe 1223/2009;
b) razumno predvidljive uvjete izloženosti;
7. ime i broj CAS (Chemicals Abstracts Service) ili EZ broj za tvari koje su razvrstane kao karcinogene, mutagene ili toksične za reprodukciju (CMR) kategorije 1A ili 1B u skladu s dijelom 3. Priloga VI. Uredbi (EZ) br. 1272/2008;
8. okvirnu formulaciju koja omogućuje brzo i primjereno liječenje u slučaju poteškoća.
Kada se kozmetički proizvod stavlja na tržište, odgovorna osoba dostavlja Europskoj komisiji podatke o izvornoj oznaci, i ako je čitljiva, fotografiju odnosne ambalaže.
Distributer koji osigurava dostupnost u državi članici kozmetičkog proizvoda koji je već stavljen na tržište druge države članice te na vlastitu inicijativu prevede podatke na oznaci proizvoda kako bi se uskladio s nacionalnim pravom, dostavlja Europskoj komisiji u elektroničkom obliku sljedeće podatke:
1. kategoriju kozmetičkog proizvoda, njegovo ime u državi članici otpreme i njegovo ime u državi članici u kojoj postaje dostupan, što omogućuje njegovu identifikaciju;
2. državu članicu u kojoj kozmetički proizvod postaje dostupan;
3. vlastito ime i adresu;
4. ime i adresu odgovorne osobe pri kojoj je izravno dostupna dokumentacija s podacima o proizvodu.
Notifikacija/obavješćivanje kozmetičkih proizvoda vrši se elektroničkim putem preko portala CPNP (eng. Cosmetic products notification portal) koji je dostupan na mrežnim stranicama Europske komisije.
CPNP portal je dostupan na sljedećoj internetskoj stranici: http://ec.europa.eu/growth/sectors/cosmetics/cpnp/index_en.htm
Na navedenim mrežnim stranicama nalaze se Korisnički priručnici za prijavu kozmetičkog proizvoda na CPNP portal sukladno članku 13. i članku 16. Uredbe 1223/2009, a koji služe kao korisno sredstvo upoznavanja s načinom registracije u sustav, kao i korištenjem portala za notifikaciju kozmetičkih proizvoda.
Dužnost svake odgovorne osobe je da unutar svoje tvrtke/obrta/OPG-a odredi odgovornu osobu koja će se registrirati na portal i notificirati proizvode.
Upute za prijavu na portal CPNP
CPNP - hodogram aktivnosti
Proizvodnja kozmetičkih proizvoda
Proizvodnja kozmetičkih proizvoda u Republici Hrvatskoj uređena je Zakonom o predmetima opće uporabe („Narodne novine“, br. 39/13, 47/14 i 114/18) i Pravilnikom o posebnim uvjetima za proizvodnju i stavljanje na tržište predmeta opće uporabe („Narodne novine“, br. 80/18).
Provođenje odredbi iz Zakona i Pravilnika obvezno je za SVE proizvođače kozmetičkih proizvoda u Republici Hrvatskoj. Prema definiciji iz Zakona proizvodnjom se smatra priprema, obrada, prerada, dorada i pakiranje te čuvanje kod proizvođača kozmetičkih proizvoda.
Pravilnik o posebnim uvjetima za proizvodnju i stavljanje na tržište predmeta opće uporabe („Narodne novine“, br. 80/18) navodi sve posebne uvjete koje prostor u kojemu se odvija proizvodnja kozmetičkih proizvoda mora ispunjavati.
Svaki proizvođač koji po definiciji proizvodnje kozmetičkih proizvoda spada u tu kategoriju dužan je Ministarstvu zdravstva, sukladno članku 21. gore navedenog Pravilnika, prijaviti djelatnost proizvodnje putem obrasca iz Priloga I. Pravilnika.
Osim što prostor mora udovoljavati propisanim posebnim uvjetima, isto tako, proizvođač kozmetičkih proizvoda mora, sukladno članku 18., stavku 1. gore navedenog Pravilnika, ispunjavati i uvjete iz Hrvatske norme o smjernicama za dobru proizvođačku praksu iz područja kozmetike, HRN EN ISO 22716:2007, odnosno proizvodnja kozmetičkih proizvoda mora biti u skladu s načelima dobre proizvođačke prakse (eng. Good Manufacturing Practice). Navedena norma dostupna je za prodaju u Hrvatskom zavodu za norme, Ulica Grada Vukovara 78, Zagreb.
Vodič za proizvodnju kozmetičkih proizvoda
Kako poslati obrazac prijave djelatnosti proizvodnje?
Propisno ispunjen obrazac potrebno je dostaviti na sljedeću adresu:
Ministarstvo zdravstva
Ksaver 200A
10 000 Zagreb
Nakon uredno zaprimljenog zahtjeva, Ministarstvo zdravstva će izdati Potvrdu o prijavi djelatnosti.
Obrazac za prijavu možete preuzeti ovdje:
Obrazac za prijavu djelatnosti
Provođenje odredbi iz Zakona i Pravilnika obvezno je za SVE proizvođače kozmetičkih proizvoda u Republici Hrvatskoj. Prema definiciji iz Zakona proizvodnjom se smatra priprema, obrada, prerada, dorada i pakiranje te čuvanje kod proizvođača kozmetičkih proizvoda.
Pravilnik o posebnim uvjetima za proizvodnju i stavljanje na tržište predmeta opće uporabe („Narodne novine“, br. 80/18) navodi sve posebne uvjete koje prostor u kojemu se odvija proizvodnja kozmetičkih proizvoda mora ispunjavati.
Svaki proizvođač koji po definiciji proizvodnje kozmetičkih proizvoda spada u tu kategoriju dužan je Ministarstvu zdravstva, sukladno članku 21. gore navedenog Pravilnika, prijaviti djelatnost proizvodnje putem obrasca iz Priloga I. Pravilnika.
Osim što prostor mora udovoljavati propisanim posebnim uvjetima, isto tako, proizvođač kozmetičkih proizvoda mora, sukladno članku 18., stavku 1. gore navedenog Pravilnika, ispunjavati i uvjete iz Hrvatske norme o smjernicama za dobru proizvođačku praksu iz područja kozmetike, HRN EN ISO 22716:2007, odnosno proizvodnja kozmetičkih proizvoda mora biti u skladu s načelima dobre proizvođačke prakse (eng. Good Manufacturing Practice). Navedena norma dostupna je za prodaju u Hrvatskom zavodu za norme, Ulica Grada Vukovara 78, Zagreb.
Vodič za proizvodnju kozmetičkih proizvoda
Kako poslati obrazac prijave djelatnosti proizvodnje?
Propisno ispunjen obrazac potrebno je dostaviti na sljedeću adresu:
Ministarstvo zdravstva
Ksaver 200A
10 000 Zagreb
Nakon uredno zaprimljenog zahtjeva, Ministarstvo zdravstva će izdati Potvrdu o prijavi djelatnosti.
Obrazac za prijavu možete preuzeti ovdje:
Obrazac za prijavu djelatnosti
Dobra proizvođačka praksa
Proizvodnja kozmetičkih proizvoda mora biti u skladu s načelima dobre proizvođačke prakse (eng. Good Manufacturing Practice, GMP).
U Službenom listu Europske unije objavljena je obavijest Komisije u okviru provedbe Uredbe 1223/2009 o kozmetičkim proizvodima gdje je objavljen naslov i referenca na harmoniziranu normu EN ISO 22716: 2007, Kozmetika - Dobra proizvođačka praksa (GMP) - Smjernice za dobru proizvođačku praksu (ISO 22716:2007).
ISO 22716:2007 je međunarodna norma koja propisuje smjernice za proizvodnju, upravljanje, kontrolu, skladištenje i distribuciju kozmetičkih proizvoda. Smjernice ujedno propisuju i organizacijske i praktične savjete za upravljanje ljudskim, tehničkim i administrativnim čimbenicima koji utječu na kvalitetu proizvodnje.
Navedena norma je dostupna za kupnju pri Hrvatskom zavodu za norme, Ulica Grada Vukovara 78, Zagreb.
U Službenom listu Europske unije objavljena je obavijest Komisije u okviru provedbe Uredbe 1223/2009 o kozmetičkim proizvodima gdje je objavljen naslov i referenca na harmoniziranu normu EN ISO 22716: 2007, Kozmetika - Dobra proizvođačka praksa (GMP) - Smjernice za dobru proizvođačku praksu (ISO 22716:2007).
ISO 22716:2007 je međunarodna norma koja propisuje smjernice za proizvodnju, upravljanje, kontrolu, skladištenje i distribuciju kozmetičkih proizvoda. Smjernice ujedno propisuju i organizacijske i praktične savjete za upravljanje ljudskim, tehničkim i administrativnim čimbenicima koji utječu na kvalitetu proizvodnje.
Navedena norma je dostupna za kupnju pri Hrvatskom zavodu za norme, Ulica Grada Vukovara 78, Zagreb.
Prijava ozbiljnih neželjenih učinaka kozmetičkih proizvoda (kozmetovigilancija)
Uredba 1223/2009 o kozmetičkim proizvodima stvorila je uniformirani pristup upravljanju ozbiljnim neželjenim učincima koji nastaju uporabom kozmetičkih proizvoda (serious undesirable effects - SUE).
Neželjeni učinak je štetno djelovanje na zdravlje ljudi čiji uzrok može biti uobičajena ili razumno predvidljiva uporaba kozmetičkog proizvoda.
Ozbiljni neželjeni učinak je neželjeni učinak čija su posljedica:
- privremena ili trajna funkcionalna nesposobnost,
- invaliditet,
- hospitalizacija,
- prirođeni poremećaj ili
- izravna životna opasnost ili
- smrt.
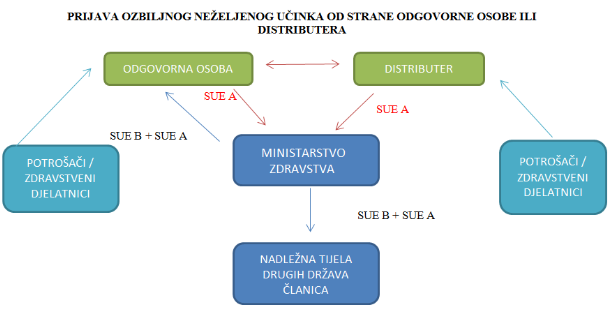
Članak 23. Uredbe 1223/2009 o kozmetičkim proizvodima navodi kako u slučaju ozbiljnih neželjenih učinaka, odgovorna osoba (proizvođač ili uvoznik) i distributeri bez odgode obavješćuju nadležno tijelo države članice u kojoj je došlo do pojave tog ozbiljnog neželjenog učinka o sljedećem (obrazac SUE A):
Nakon što odgovorna osoba prijavi ozbiljne neželjene učinke nadležnom tijelu države članice u kojoj je došlo do njihove pojave, to nadležno tijelo odmah prosljeđuje podatke nadležnim tijelima ostalih država članica (obrazac SUE B).
Nakon što distributeri prijave ozbiljne neželjene učinke nadležnom tijelu države članice u kojoj je došlo do njihove pojave, to nadležno tijelo odmah prosljeđuje podatke nadležnim tijelima ostalih država članica i odgovornoj osobi.
Nakon što krajnji korisnici ili zdravstveno osoblje prijave ozbiljne neželjene učinke nadležnom tijelu države članice u kojoj je došlo do njihove pojave, to nadležno tijelo odmah prosljeđuje podatke o kozmetičkom proizvodu u pitanju nadležnim tijelima ostalih država članica i odgovornoj osobi (obrazac SUE C).
Kod prijave ozbiljnog neželjenog učinka poželjno je navesti što više podataka o spornom proizvodu (slika proizvoda, broj šarže, ime uvoznika, odgovorna osoba, mjesto kupnje ako je moguće, te ispuniti podatke iz obrasca koje su važne za slučaj).
Sve vrste ozbiljnih neželjenih učinaka nastalih uporabom kozmetičkih proizvoda prijavljuju se Ministarstvu zdravstva, Odjel za predmete opće uporabe i zaštitu od buke na e-mail: kozmetovigilancija@miz.hr
U slučajevima kada se radi o zdravstveno neispravnom proizvodu (strani miris i izgled, sumnjiva kategorija proizvoda te deklariranje ljekovitih svojstava a nije lijek), prijava se podnosi putem obrasca dostupnog na slijedećoj stranici: https://dirh.gov.hr/podnosenje-prijava/83.
Prijava o ozbiljnim neželjenim učincima kozmetičkih proizvoda obvezna je za proizvođače, uvoznike i distributere. Ozbiljne neželjene učinke mogu prijaviti i krajnji korisnici (potrošači) ili zdravstveni djelatnici.
Kako bi se olakšala prijava o ozbiljnim neželjenim učincima kozmetičkih proizvoda, Europska komisija je izradila Smjernice za izvještavanje o ozbiljnim neželjenim učincima koji nastaju uporabom kozmetičkih proizvoda (serious undesirable effects - SUE). Tu su i smjernice za Procjenu uzročnosti neželjenih posljedica uzrokovanih kozmetičkim proizvodima.
Obrazac kojim odgovorne osobe i distributeri prijavljuju ozbiljne neželjene učinke nastale uporabom kozmetičkih proizvoda dostupan je na sljedećem linku: SUE A
Upute za ispunjavanje obrasca SUE A
Hodogram aktivnosti prijave ozbiljnog neželjenog učinka:
Upute za ispunjavanje obrasca SUE C
Neželjeni učinak je štetno djelovanje na zdravlje ljudi čiji uzrok može biti uobičajena ili razumno predvidljiva uporaba kozmetičkog proizvoda.
Ozbiljni neželjeni učinak je neželjeni učinak čija su posljedica:
- privremena ili trajna funkcionalna nesposobnost,
- invaliditet,
- hospitalizacija,
- prirođeni poremećaj ili
- izravna životna opasnost ili
- smrt.
Članak 23. Uredbe 1223/2009 o kozmetičkim proizvodima navodi kako u slučaju ozbiljnih neželjenih učinaka, odgovorna osoba (proizvođač ili uvoznik) i distributeri bez odgode obavješćuju nadležno tijelo države članice u kojoj je došlo do pojave tog ozbiljnog neželjenog učinka o sljedećem (obrazac SUE A):
- svim ozbiljnim neželjenim učincima koji su im poznati ili za koje se razumno može očekivati da su im poznati,
- nazivu kozmetičkog proizvoda u pitanju, što omogućuje njegovu točnu identifikaciju;
- korektivnim mjerama koje su poduzeli.
Nakon što odgovorna osoba prijavi ozbiljne neželjene učinke nadležnom tijelu države članice u kojoj je došlo do njihove pojave, to nadležno tijelo odmah prosljeđuje podatke nadležnim tijelima ostalih država članica (obrazac SUE B).
Nakon što distributeri prijave ozbiljne neželjene učinke nadležnom tijelu države članice u kojoj je došlo do njihove pojave, to nadležno tijelo odmah prosljeđuje podatke nadležnim tijelima ostalih država članica i odgovornoj osobi.
Nakon što krajnji korisnici ili zdravstveno osoblje prijave ozbiljne neželjene učinke nadležnom tijelu države članice u kojoj je došlo do njihove pojave, to nadležno tijelo odmah prosljeđuje podatke o kozmetičkom proizvodu u pitanju nadležnim tijelima ostalih država članica i odgovornoj osobi (obrazac SUE C).
Kod prijave ozbiljnog neželjenog učinka poželjno je navesti što više podataka o spornom proizvodu (slika proizvoda, broj šarže, ime uvoznika, odgovorna osoba, mjesto kupnje ako je moguće, te ispuniti podatke iz obrasca koje su važne za slučaj).
Sve vrste ozbiljnih neželjenih učinaka nastalih uporabom kozmetičkih proizvoda prijavljuju se Ministarstvu zdravstva, Odjel za predmete opće uporabe i zaštitu od buke na e-mail: kozmetovigilancija@miz.hr
U slučajevima kada se radi o zdravstveno neispravnom proizvodu (strani miris i izgled, sumnjiva kategorija proizvoda te deklariranje ljekovitih svojstava a nije lijek), prijava se podnosi putem obrasca dostupnog na slijedećoj stranici: https://dirh.gov.hr/podnosenje-prijava/83.
Prijava o ozbiljnim neželjenim učincima kozmetičkih proizvoda obvezna je za proizvođače, uvoznike i distributere. Ozbiljne neželjene učinke mogu prijaviti i krajnji korisnici (potrošači) ili zdravstveni djelatnici.
Kako bi se olakšala prijava o ozbiljnim neželjenim učincima kozmetičkih proizvoda, Europska komisija je izradila Smjernice za izvještavanje o ozbiljnim neželjenim učincima koji nastaju uporabom kozmetičkih proizvoda (serious undesirable effects - SUE). Tu su i smjernice za Procjenu uzročnosti neželjenih posljedica uzrokovanih kozmetičkim proizvodima.
Obrazac kojim odgovorne osobe i distributeri prijavljuju ozbiljne neželjene učinke nastale uporabom kozmetičkih proizvoda dostupan je na sljedećem linku: SUE A
Upute za ispunjavanje obrasca SUE A
Hodogram aktivnosti prijave ozbiljnog neželjenog učinka:

Upute za ispunjavanje obrasca SUE C
Korisni linkovi i vodiči
Općenito o kozmetičkim proizvodima na razini Europske unije
Općenito o graničnim proizvodima na razini Europske unije
CosIng baza podataka - sastojci za kozmetičke proizvode
Korisni vodiči
Vodič za sigurnu kozmetiku za djecu (za proizvođače i procjenitelje sigurnosti)
Guidance on essential oils in cosmetic_2nd-edition 2024.PDF
Općenito o graničnim proizvodima na razini Europske unije
CosIng baza podataka - sastojci za kozmetičke proizvode
Korisni vodiči
Vodič za sigurnu kozmetiku za djecu (za proizvođače i procjenitelje sigurnosti)
Guidance on essential oils in cosmetic_2nd-edition 2024.PDF
Granični proizvodi i vodiči
Ponekad je nejasno da li određeni proizvod, a sukladno svojem obilježju i funkciji, može biti kategoriziran kao kozmetički proizvod prema propisima koji reguliraju kozmetičke proizvode ili spada u druge sektorske propise.
Europska komisija objavila određene smjernice kako bi se olakšala primjena zakonodavstva EU, a koji uključuju Vodiče o opsegu primjene Uredbe 1223/2009 o kozmetičkim proizvodima i Vodiče između legislative kozmetičkih proizvoda i biocida te lijekova, a koji nisu pravno obvezujući nego služe za pomoć pri kategorizaciji proizvoda.
Europska komisija objavila određene smjernice kako bi se olakšala primjena zakonodavstva EU, a koji uključuju Vodiče o opsegu primjene Uredbe 1223/2009 o kozmetičkim proizvodima i Vodiče između legislative kozmetičkih proizvoda i biocida te lijekova, a koji nisu pravno obvezujući nego služe za pomoć pri kategorizaciji proizvoda.
- Vodič za granične proizvode između kozmetičkih proizvoda i lijekova
- Vodič za granične proizvode između kozmetičkih proizvodia i biocida
- Vodič o primjeni Uredbe 1223 2009 o kozmetičkim proizvodima_manual nov 2017_en
- Vodič o općoj sigurnosti proizvoda i ostalim proizvodima
- Technical_document_CLAIMS_2017_en
- Izvješće Komisije EU Parlamentu o tvrdnjama znesenim o proizvodima na temelju zajedničkih kriterija
- Provedbena Odluka Komisije o Smjernicama za primjenu Priloga I. Uredbe 1223 2009
- Uredba 655 2013 o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji na kozmetičkim proizvodima
Sredstva za zaštitu od sunca
Sredstva za zaštitu od sunca kozmetički su proizvodi, sukladno Uredbi (EZ) br. 1223/2009 o kozmetičkim proizvodima, koji štite od UV zračenja.
Učinkovitost sredstva za zaštitu od sunca i način na koji se ta učinkovitost tvrdi važna su pitanja javnog zdravlja, iz razloga jer:
Preporuka Europske komisije o učinkovitosti sredstva za zaštitu od sunca i tvrdnje koje se na njih odnose (2006/647/EZ) usvojena je 2006. godine, određuje sljedeće:
Tvrdnje za UVA i UVB zaštitu smiju biti navedene na sredstvima za zaštitu od sunca samo ako je zaštita tih sredstava jednaka ili veća od razina koje su navedene u točki 10. Preporuke Europske komisije o učinkovitosti sredstva za zaštitu od sunca i tvrdnje koje se na njih odnose (2006/647/EZ).
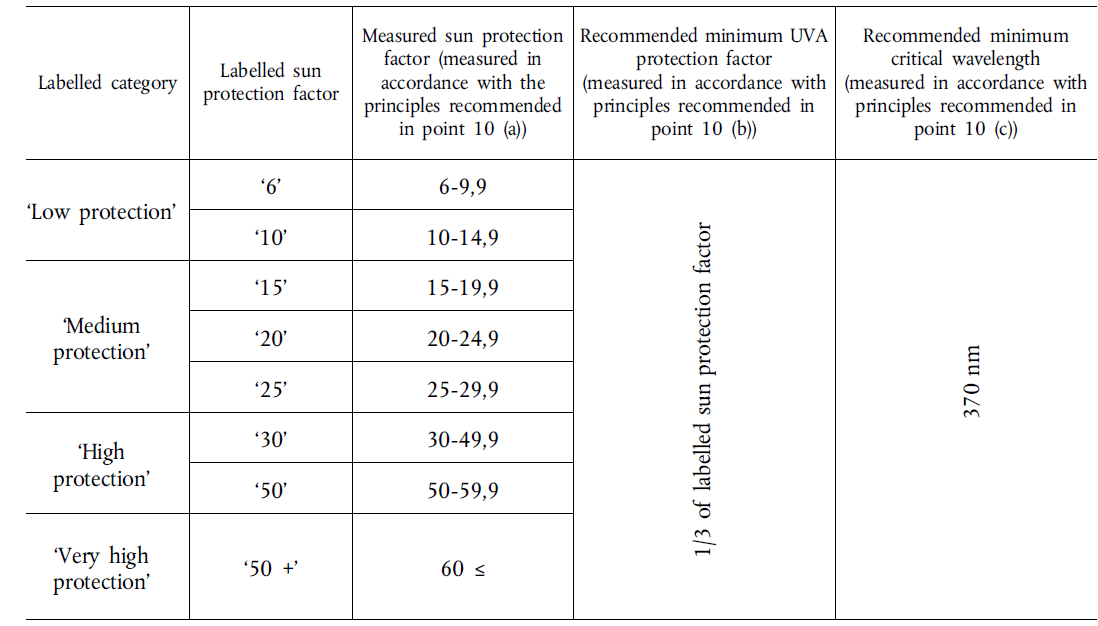
Učinkovitost sredstva za zaštitu od sunca smiju biti navedene prema sljedećim kategorijama: "niska", "srednja", "visoka" i "vrlo visoka", s tim da svaka kategorija treba biti jednaka stupnju zaštite za UVA i UVB zračenja.
Zaštitni faktori sredstva za zaštitu od sunca su sljedeći:
Sukladno Preporuci Europske komisije o učinkovitosti sredstva za zaštitu od sunca i tvrdnje koje se na njih odnose (2006/647/EZ) i Udruge Cosmetics Europe preporuča se da se na deklaraciji sredstva za zaštitu od sunca navodi riječ "UVA", tiskana u jednostavnom kružnom obliku. Promjer logotipa ne smije prelaziti visinu SPF broja.
Tvrdnje na sredstvima za zaštitu od sunca mogu dovesti do ozbiljnih neželjenih učinaka ako one nisu točne, ne poštuju kriterije istinitosti, dokazne građe, poštenja, pravednosti i informiranog odlučivanja, a utvrđene su Uredbom Komisije (EU) 655/2013 o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji koje se koriste u vezi s kozmetičkim proizvodima.
Proizvođači kozmetičkih proizvoda i njihove odgovorne osobe dužni su poštivati gore navedene odredbe čime bi se osigurala sigurnost i zdravstvena ispravnost proizvoda za krajnje korisnike odnosno potrošače.
Povezani dokumenti:
Učinkovitost sredstva za zaštitu od sunca i način na koji se ta učinkovitost tvrdi važna su pitanja javnog zdravlja, iz razloga jer:
- proizvodi trebaju sadržavati zaštitu od svih opasnih UV zračenja
- oznaka o učinkovitosti sredstva za zaštitu od sunca treba biti jednostavna i smislena, i treba se temeljiti na standardiziranim i preciznim kriterijima
- oznake i tvrdnje trebaju pružiti dovoljno informacija kako bi pomogli potrošačima odabrati odgovarajući proizvod i način njegove pravilne primjene.
Preporuka Europske komisije o učinkovitosti sredstva za zaštitu od sunca i tvrdnje koje se na njih odnose (2006/647/EZ) usvojena je 2006. godine, određuje sljedeće:
- tvrdnje koje se ne smiju navoditi na sredstvima za zaštitu od sunca
- mjere opreza, uključujući i upute za uporabu
- minimalni stupanj učinkovitosti sredstva za zaštitu od sunca kako bi se osigurala visoka razina zaštite javnog zdravlja
- jednostavno i razumljivo označavanje proizvoda.
Tvrdnje za UVA i UVB zaštitu smiju biti navedene na sredstvima za zaštitu od sunca samo ako je zaštita tih sredstava jednaka ili veća od razina koje su navedene u točki 10. Preporuke Europske komisije o učinkovitosti sredstva za zaštitu od sunca i tvrdnje koje se na njih odnose (2006/647/EZ).
Učinkovitost sredstva za zaštitu od sunca smiju biti navedene prema sljedećim kategorijama: "niska", "srednja", "visoka" i "vrlo visoka", s tim da svaka kategorija treba biti jednaka stupnju zaštite za UVA i UVB zračenja.
Zaštitni faktori sredstva za zaštitu od sunca su sljedeći:

Sukladno Preporuci Europske komisije o učinkovitosti sredstva za zaštitu od sunca i tvrdnje koje se na njih odnose (2006/647/EZ) i Udruge Cosmetics Europe preporuča se da se na deklaraciji sredstva za zaštitu od sunca navodi riječ "UVA", tiskana u jednostavnom kružnom obliku. Promjer logotipa ne smije prelaziti visinu SPF broja.
Tvrdnje na sredstvima za zaštitu od sunca mogu dovesti do ozbiljnih neželjenih učinaka ako one nisu točne, ne poštuju kriterije istinitosti, dokazne građe, poštenja, pravednosti i informiranog odlučivanja, a utvrđene su Uredbom Komisije (EU) 655/2013 o utvrđivanju zajedničkih kriterija za opravdanje tvrdnji koje se koriste u vezi s kozmetičkim proizvodima.
Proizvođači kozmetičkih proizvoda i njihove odgovorne osobe dužni su poštivati gore navedene odredbe čime bi se osigurala sigurnost i zdravstvena ispravnost proizvoda za krajnje korisnike odnosno potrošače.
Povezani dokumenti:
- HZJZ_sredstva-za-zastitu-od-sunca/
- Europska komisija/sectors/cosmetics/products/sunscreen_fr
- CosmeticsEurope.eu/cosmetic-products/understanding-label/
Kozmetički proizvodi koji sadrže nanomaterijale
Uredba 1223/2009 o kozmetičkim proizvodima definira pojam „nanomaterijal“ kao netopiv ili biološki postojan i namjenski proizveden materijal s jednom ili više vanjskih dimenzija, ili s unutarnjom strukturom od 1 do 100 nm.
Europska komisija je izdala Odluku o definiciji nanomaterijala, koja postavlja graničnu vrijednost 50% ili više čestica, ovisno o broju.
Za nanomaterijale propisano je sljedeće:
1. Nanaomaterijali u kozmetičkim proizvodima mogu se koristiti kao bojila, konzervansi i UV-filtri, a koji su navedeni u Prilogu IV. (Popis dopuštenih bojila u kozmetičkim proizvodima), Prilogu V. (Lista konzervansa koje kozmetički proizvodi mogu sadržavati) i Prilogu VI. (Lista dopuštenih UV-filtera koje mogu sadržavati kozmetički proizvodi).
Tvari navedene u Prilogu IV. do VI. ne pokrivaju nanomaterijale, osim gdje je izričito navedeno.
Do sada su uključeni u Prilog VI. sljedeći nanomaterijali: cink oksid (nano), titanijev dioksid (nano) i tris-bifenil triazin (nano), dok je čađa – carbon black (nano) uključen u Prilog IV.
2. Sukladno članku 16. Uredbe, uz obavijesti iz članka 13., odgovorna osoba obavješćuje Komisiju u elektroničkom obliku o kozmetičkim proizvodima koji sadrže nanomaterijale, i to šest mjeseci prije njihova stavljanja na tržište.
Odredbe članka 16. ne odnose se na nanomaterijale koji se koriste kao bojila, UV-filtri ili konzervansi koji su uređeni člankom 14., osim ako to nije izričito navedeno.
Odgovorna osoba mora izvršiti prijavu šest mjeseci prije stavljanja kozmetičkog proizvoda na tržište EU. Odgovorna osoba može pismeno imenovati drugu pravnu ili fizičku osobu za obavješćivanje o nanomaterijalima i o tome obavješćuje Europsku komisiju.
Podaci koji se dostavljaju Eurospkoj komisiji moraju uključivati sljedeće:
1. identifikaciju nanomaterijala, uključujući njegov kemijski naziv (IUPAC) i druge deskriptore kako je utvrđeno u točki 2. preambule priloga II. do VI.;
2. specifikaciju nanomaterijala, uključujući veličinu čestica, te fizikalna i kemijska svojstva;
3. procjenu količine nanomaterijala sadržane u kozmetičkim proizvodima koje se namjerava godišnje staviti na tržište;
4. toksikološki profil nanomaterijala;
5. podatke o sigurnosti nanomaterijala u vezi s kategorijom kozmetičkog proizvoda, s obzirom na način uporabe u tim proizvodima;
6. razumno predvidljive uvjete izloženosti.
Notifikacija/obavješćivanje kozmetičkih proizvoda koji sadrže nanomaterijale vrši se, također elektroničkim putem preko portala CPNP (eng. Cosmetic products notification portal).
Europska komisija je na svojoj internetskoj stranici objavila Priručnik za prijavu kozmetičkih proizvoda koji sadrže nanomaterijale te Pitanja i odgovore za notifikaciju kozmetičkih proizvoda koji sadrže nanomaterijale.
3. Svi sastojci prisutni u obliku nanomaterijala moraju biti jasno naznačeni na deklaraciji kozmetičkih proizvoda s oznakom na popisu sastojaka. Nakon imena tih sastojaka u zagradi mora slijediti riječ „nano”.
Europska komisija osigurava dostupnost kataloga svih nanomaterijala koji se koriste u kozmetičkim proizvodima na tržištu, uključujući i onih koji se koriste kao bojila, UV-filtri i konzervansi, te kategoriju kozmetičkih proizvoda i razumno predvidljive uvjete izloženosti. Taj se katalog redovito ažurira i javno je dostupan pri Komisiji.
Više o nanomaterijalima u kozmetičkim proizvodima na sljedećoj mrežnoj stranici Europske komisije:
https://ec.europa.eu/growth/sectors/cosmetics/products/nanomaterials_en
Europska komisija je izdala Odluku o definiciji nanomaterijala, koja postavlja graničnu vrijednost 50% ili više čestica, ovisno o broju.
Za nanomaterijale propisano je sljedeće:
1. Nanaomaterijali u kozmetičkim proizvodima mogu se koristiti kao bojila, konzervansi i UV-filtri, a koji su navedeni u Prilogu IV. (Popis dopuštenih bojila u kozmetičkim proizvodima), Prilogu V. (Lista konzervansa koje kozmetički proizvodi mogu sadržavati) i Prilogu VI. (Lista dopuštenih UV-filtera koje mogu sadržavati kozmetički proizvodi).
Tvari navedene u Prilogu IV. do VI. ne pokrivaju nanomaterijale, osim gdje je izričito navedeno.
Do sada su uključeni u Prilog VI. sljedeći nanomaterijali: cink oksid (nano), titanijev dioksid (nano) i tris-bifenil triazin (nano), dok je čađa – carbon black (nano) uključen u Prilog IV.
2. Sukladno članku 16. Uredbe, uz obavijesti iz članka 13., odgovorna osoba obavješćuje Komisiju u elektroničkom obliku o kozmetičkim proizvodima koji sadrže nanomaterijale, i to šest mjeseci prije njihova stavljanja na tržište.
Odredbe članka 16. ne odnose se na nanomaterijale koji se koriste kao bojila, UV-filtri ili konzervansi koji su uređeni člankom 14., osim ako to nije izričito navedeno.
Odgovorna osoba mora izvršiti prijavu šest mjeseci prije stavljanja kozmetičkog proizvoda na tržište EU. Odgovorna osoba može pismeno imenovati drugu pravnu ili fizičku osobu za obavješćivanje o nanomaterijalima i o tome obavješćuje Europsku komisiju.
Podaci koji se dostavljaju Eurospkoj komisiji moraju uključivati sljedeće:
1. identifikaciju nanomaterijala, uključujući njegov kemijski naziv (IUPAC) i druge deskriptore kako je utvrđeno u točki 2. preambule priloga II. do VI.;
2. specifikaciju nanomaterijala, uključujući veličinu čestica, te fizikalna i kemijska svojstva;
3. procjenu količine nanomaterijala sadržane u kozmetičkim proizvodima koje se namjerava godišnje staviti na tržište;
4. toksikološki profil nanomaterijala;
5. podatke o sigurnosti nanomaterijala u vezi s kategorijom kozmetičkog proizvoda, s obzirom na način uporabe u tim proizvodima;
6. razumno predvidljive uvjete izloženosti.
Notifikacija/obavješćivanje kozmetičkih proizvoda koji sadrže nanomaterijale vrši se, također elektroničkim putem preko portala CPNP (eng. Cosmetic products notification portal).
Europska komisija je na svojoj internetskoj stranici objavila Priručnik za prijavu kozmetičkih proizvoda koji sadrže nanomaterijale te Pitanja i odgovore za notifikaciju kozmetičkih proizvoda koji sadrže nanomaterijale.
3. Svi sastojci prisutni u obliku nanomaterijala moraju biti jasno naznačeni na deklaraciji kozmetičkih proizvoda s oznakom na popisu sastojaka. Nakon imena tih sastojaka u zagradi mora slijediti riječ „nano”.
Europska komisija osigurava dostupnost kataloga svih nanomaterijala koji se koriste u kozmetičkim proizvodima na tržištu, uključujući i onih koji se koriste kao bojila, UV-filtri i konzervansi, te kategoriju kozmetičkih proizvoda i razumno predvidljive uvjete izloženosti. Taj se katalog redovito ažurira i javno je dostupan pri Komisiji.
Više o nanomaterijalima u kozmetičkim proizvodima na sljedećoj mrežnoj stranici Europske komisije:
https://ec.europa.eu/growth/sectors/cosmetics/products/nanomaterials_en
Tvari koje su klasificirane kao kancerogene, mutagene ili toksične (CMR)
U kozmetičkim proizvodima zabranjeno je koristiti tvari razvrstane kao kancerogene, mutagene ili toksične za reprodukciju (CMR) u kategorijama 1A, 1B i 2 u skladu s dijelom 3. Priloga VI. Uredbe 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa.
CMR tvari mogu se koristiti u kozmetičkim proizvodima ako su ih procijenili od strane Znanstvenog odbora za zaštitu potrošača (SCCS) i za koje se utvrdilo da su sigurni za uporabu u kozmetičkim proizvodima.
CMR tvari kategorije 1A ili 1B mogu se iznimno koristiti u kozmetičkim proizvodima samo ako su ispunjeni sljedeći uvjeti:
• ispunjavaju zahtjeve o sigurnosti hrane, kako je utvrđeno Uredbom 178/2002 o utvrđivanju općih načela i uvjeta propisa o hrani,
• nisu dostupne zaštitne alternativne tvari, kako je dokazano analizom alternativnih mogućnosti,
• zahtjev se odnosi na posebnu uporabu kategorije proizvoda s poznatom izloženosti; i
• SCCS ih je ocijenio i utvrdio da su sigurne za uporabu u kozmetičkim proizvodima, a posebno s obzirom na izloženost tim proizvodima i uzimajući u obzir ukupnu izloženost iz drugih izvora, te vodeći računa o osjetljivim društvenim skupinama.
Od 1. prosinca 2010. primjenjuju se odredbe o uporabi CMR tvari u kozmetičkim proizvodima.
CMR tvari mogu se koristiti u kozmetičkim proizvodima ako su ih procijenili od strane Znanstvenog odbora za zaštitu potrošača (SCCS) i za koje se utvrdilo da su sigurni za uporabu u kozmetičkim proizvodima.
CMR tvari kategorije 1A ili 1B mogu se iznimno koristiti u kozmetičkim proizvodima samo ako su ispunjeni sljedeći uvjeti:
• ispunjavaju zahtjeve o sigurnosti hrane, kako je utvrđeno Uredbom 178/2002 o utvrđivanju općih načela i uvjeta propisa o hrani,
• nisu dostupne zaštitne alternativne tvari, kako je dokazano analizom alternativnih mogućnosti,
• zahtjev se odnosi na posebnu uporabu kategorije proizvoda s poznatom izloženosti; i
• SCCS ih je ocijenio i utvrdio da su sigurne za uporabu u kozmetičkim proizvodima, a posebno s obzirom na izloženost tim proizvodima i uzimajući u obzir ukupnu izloženost iz drugih izvora, te vodeći računa o osjetljivim društvenim skupinama.
Od 1. prosinca 2010. primjenjuju se odredbe o uporabi CMR tvari u kozmetičkim proizvodima.
Konzervansi
Konzervansi su tvari koje su isključivo ili prvenstveno namijenjene sprečavanju razvoja mikroorganizama u kozmetičkom proizvodu.
Konzervansi štite proizvode od kontaminacije s mikroorganizmima (npr. bakterije, gljivice, plijesni) i mogu produljiti rok trajanja kozmetičkih proizvoda.
Kozmetički proizvodi mogu sadržavati samo konzervanse navedene u Prilogu V. Uredbe 1223/2009 o kozmetičkim proizvodima.
Više informacija o konzervansima u kozmetičkim proizvodima na mrežnim stranicama Europske komisije:
https://ec.europa.eu/growth/sectors/cosmetics/products/preservatives_en
Često postavljana opća i tehnička pitanja o konzervansima u kozmetičkim proizvodima dostupna su ovdje.
Konzervansi štite proizvode od kontaminacije s mikroorganizmima (npr. bakterije, gljivice, plijesni) i mogu produljiti rok trajanja kozmetičkih proizvoda.
Kozmetički proizvodi mogu sadržavati samo konzervanse navedene u Prilogu V. Uredbe 1223/2009 o kozmetičkim proizvodima.
Više informacija o konzervansima u kozmetičkim proizvodima na mrežnim stranicama Europske komisije:
https://ec.europa.eu/growth/sectors/cosmetics/products/preservatives_en
Često postavljana opća i tehnička pitanja o konzervansima u kozmetičkim proizvodima dostupna su ovdje.
Obavijest o zabrani kozmetičkih proizvoda koji sadrže TPO
Od 1. rujna 2025. godine stupa na snagu zabrana uporabe sastojka TPO (Trimethylbenzoyl Diphenylphosphine Oxide) u kozmetičkim proizvodima, uključujući lakove za nokte, sukladno Uredbi Komisije (EU) 2025/877 o izmjeni Uredbe (EZ) br. 1223/2009 Europskog parlamenta i Vijeća.
Riječ je o provedbi zakonodavstva Europske unije kojim se zabranjuje uporaba tvari koje su razvrstane kao karcinogene, mutagene ili reproduktivno toksične (CMR) u kozmetičkim proizvodima.
Ključne odredbe Uredbe (EU) 2025/877:
Pozivamo sve gospodarske subjekte - proizvođače, uvoznike, distributere, maloprodajne subjekte i profesionalne korisnike - da pravovremeno poduzmu sve potrebne mjere kako bi osigurali usklađenost sa zakonskim propisima i time izbjegli moguće regulatorne posljedice.
Dodatne informacije:
Za detaljnije smjernice Europska komisija objavila je na svojim stranicama često postavljana pitanja i odgovore (Q&A) koji uključuju:
Riječ je o provedbi zakonodavstva Europske unije kojim se zabranjuje uporaba tvari koje su razvrstane kao karcinogene, mutagene ili reproduktivno toksične (CMR) u kozmetičkim proizvodima.
Ključne odredbe Uredbe (EU) 2025/877:
- Od 1. rujna 2025. godine zabranjuje se stavljanje na tržište Europske unije kozmetičkih proizvoda koji sadrže TPO
- Nakon 1. rujna 2025. ne postoji dodatni prijelazni rok, što znači da nakon tog datuma takvi proizvodi više ne smiju biti dostupni potrošačima, odnosno ne smiju se nalaziti u maloprodaji, niti koristiti u okviru obavljanja profesionalne djelatnosti (u kozmetičkim salonima i salonima za uljepšavanje)
- Proizvodi koji su stavljeni na tržište prije 1. rujna 2025. ne smiju se dalje isporučivati, prenositi, prodavati ili na bilo koji drugi način staviti na raspolaganje drugim osobama u okviru komercijalne djelatnosti (drugim riječima, kozmetički saloni i profesionalne osobe ne smiju nakon tog datuma prodavati, koristiti niti poklanjati proizvode koji sadrže TPO - ni krajnjim potrošačima, ni drugim poslovnim subjektima).
Pozivamo sve gospodarske subjekte - proizvođače, uvoznike, distributere, maloprodajne subjekte i profesionalne korisnike - da pravovremeno poduzmu sve potrebne mjere kako bi osigurali usklađenost sa zakonskim propisima i time izbjegli moguće regulatorne posljedice.
Dodatne informacije:
Za detaljnije smjernice Europska komisija objavila je na svojim stranicama često postavljana pitanja i odgovore (Q&A) koji uključuju: